Wie Stresshormone Bakterien den Weg in ihrem Wirt weisen
04.03.2022
Ein neu entdecktes Protein hilft Bakterien, Stresshormone aus dem menschlichen Körper zu erkennen und sich gezielt im Wirt zu bewegen.
04.03.2022
Ein neu entdecktes Protein hilft Bakterien, Stresshormone aus dem menschlichen Körper zu erkennen und sich gezielt im Wirt zu bewegen.
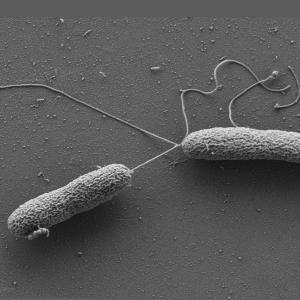
Zellen von Vibrio campbellii. Die langen Flagellen sorgen für Beweglichkeit. Aufnahme: Wanner/Jung, LMU
Bei Menschen und bei Tieren sind Katecholamine wie Adrenalin, Noradrenalin und Dopamin weit verbreitete Stresshormone. Stress kann die Anfälligkeit für bakterielle Infektionen erhöhen. Im Labor jedenfalls stimulieren Stresshormone das Wachstum verschiedener Erreger. Das wurde schon früher bei Salmonellen (Salmonella enterica serovar Typhimurium), bei Darmbakterien (Escherichia coli) oder beim Cholera-Erreger (Vibrio cholerae) beobachtet. Außerdem erleichtern es Adrenalin und Noradrenalin Bakterien, Zellen des Körpers zu infizieren. Auch die Biosynthese von Virulenzfaktoren, die Erregern die Fähigkeit verleihen, an Zellen zu haften, in Zellen einzudringen und sie zu zerstören, wird von solchen Hormonen beeinflusst.
„Wir vermuteten deshalb, dass einige Bakterien solche Hormone als Signale nutzen, um die eukaryotische Wirtsumgebung zu erkennen“, sagt die LMU-Mikrobiologin Professor Dr. Kirsten Jung. „Die molekularen Grundlagen waren bislang jedoch unbekannt.“ Zusammen mit Professor Dr. Stephan A. Sieber von der Technischen Universität München (TUM) und weiteren Forschenden hat Jung die Bindungsstelle von Adrenalin und dem Adrenalin-Derivat Phenylephrin im Bakterium Vibrio campbellii identifiziert. Ziel beider Moleküle ist das Protein CheW, wie das Team jetzt in PNAS berichtet. „Der biologische Sinn des Mechanismus ist, dass Bakterien erkennen, beispielsweise nicht mehr im Gewässer, sondern im Darm eines Wirtes zu sein“, erklärt Jung.
„Wir wollten wissen, wie Bakterien Katecholamine als Signalmoleküle erkennen“, sagt die LMU-Wissenschaftlerin. „Welche Rezeptoren steuern diesen Vorgang?“ Ihre Experimente bestanden aus mehreren Teilschritten.
Für die Studie hat Sieber eine Methode entwickelt, um Adrenalin und Phenylephrin chemisch zu modifizieren, damit man Komplexe aus den Katecholaminen und den gebundenen bakteriellen Proteinen direkt isolieren kann. Voraussetzung für die Experimente war, dass die neuen Verbindungen keine anderen biologischen Eigenschaften aufweisen, verglichen mit den unveränderten Molekülen. Das hat Jungs Gruppe anhand von Laborexperimenten gezeigt. Modifiziertes Adrenalin bindet Eisen, das Adrenalin-Derivat Phenylephrin nicht. Mit der Wahl ihrer Verbindungen wollten die Forscher Effekte, die durch eine bessere Versorgung der Bakterien mit Eisen entstehen, ausschließen.
Jung und Sieber arbeiteten mit Vibrio campbellii als Modellorganismus. Das marine Bakterium infiziert Fische, Garnelen, Tintenfische und viele wirbellose Meerestiere. Sie versetzten Vibrio campbellii mit den chemisch modifizierten Katecholaminen und lysierten die Zellen. Danach wurden alle Proteine, an die ein Molekül gebunden hatten, aus dem Lysat herausgezogen und per Proteomanalyse charakterisiert. Dabei wurde das lösliche Chemotaxis-Protein CheW besonders stark angereichert.
Anschließend hat Jungs Gruppe CheW direkt aus Bakterien isoliert, gereinigt und die Bindungsstärke an Katecholamine gemessen. Dabei fanden die Forschenden etwas Überraschendes: die Hormone binden nicht – wie ursprünglich erwartet – an die Chemorezeptoren selbst, sondern an das Kopplungsprotein CheW, das sich zwischen Rezeptoren und einer Signaltransduktionskaskade befindet. Dieses gesamte Reizwahrnehmungssystem steuert die Bewegung des Bakteriums in einem chemischen Gradienten.
„Unsere Studie liefert neue Einblicke in die Kommunikation von Bakterien mit ihrem Wirt“, fasst Jung zusammen. „Wir konnten zeigen, dass sich das Schwimmverhalten der Bakterien durch Wirtshormone verändert, was von CheW gesteuert wird.“ Die Beweglichkeit, speziell die gerichtete Beweglichkeit, ist für die Wirtsbesiedlung ganz entscheidend. Denn Bakterien versuchen, einen Organismus gezielt zu besiedeln und alle Nischen zu erobern. Im nächsten Schritt will Jung nun herausfinden, ob sich der Mechanismus auch bei anderen Bakterien nachweisen lässt.
Angela Weigert Muñoz, Elisabeth Hoyer, Kilian Schumacher, Marianne Grognot, Katja M. Taute, Stephan M. Hacker, Stephan A. Sieber, Kirsten Jung: Eukaryotic catecholamine hormones influence the chemotactic control of Vibrio campbellii by binding to the coupling protein CheW. PNAS 2022